



日前,bat365在线登录入口李大力团队报道开发出了一种全新的基于 IscB 的超高活性、且体积更小的基因编辑工具并率先实现了小鼠体内高效编辑,该项研究成果为多元化的基因治疗策略提供了新的工具。2024年8月22日,国际知名学术期刊《分子细胞》在线发表李大力团队这一研究成果,并被选为封面文章。

《分子细胞》在线发表李大力团队科研成果

李大力团队科研成果被选为《分子细胞》封面文章
《分子细胞》封面论文设计图以中国风为封面主基调,长街上的两列灯笼排列有序(代表DNA),小朋友(eIscB-D)踩着楼梯(eωRNA)去替换特定位置的灯笼(基因编辑),巧妙地呈现了基因编辑的奇妙景象。小朋友身形小巧玲珑,一手敏捷地摘下旧灯笼,另一只手挂迅速挂上新灯笼,这一精准而迅速的替换动作,象征着eIscB-D高效、小巧、准确的特点,楼梯绘画为多发卡结构,代表协助高效、精准定位的ωRNA。
|一款高活性且体积更小的基因编辑工具:具有极大的临床应用价值
以 CRISPR/Cas9 为代表的基因编辑技术在过去的十年里屡屡获奖,已成为当前炙手可热的基因编辑工具,为基础生物学和疾病治疗带来了重大变革。首个基于 CRISPR/Cas9 技术的离体(ex vivo)基因编辑疗法 CASGEVY™ 相继在英国、美国、沙特及欧盟等4个国家获批,标志着基因编辑技术已经迈进了临床应用的时代。然而,CRISPR/Cas9 系统仍然存在着一定的局限性,如体积较大导致在体(in vivo)基因疗法受到限制,又如目前适用于肝外基因递送的主要载体是腺相关病毒(AAV),但其包装上限仅4.7kb,单个病毒难以递送 Cas9 等核酸酶及其衍生编辑系统,因此寻找尺寸更小的高活性基因编辑系统对于实现安全高效的体内递送具有重大意义。
2021年,张锋团队通过挖掘和分析发现了一种由 IS200/IS605 转座子超家族编码名为 IscB 的核酸酶。作为 Cas9 可能的进化祖先,氨基酸长度仅约为 SpCas9 的三分之一左右,也利用一段非编码 RNA(ωRNA)引导蛋白识别 DNA。然而,IscB 在哺乳动物细胞中的活性非常有限。以 OgeuIscB 为例,其在 HEK293FT 细胞中编辑效率不到5%。因此,能否通过工程化的改造提高IscB的基因编辑活性,达到与 Cas9 相当的活性是需要解决的首要问题。
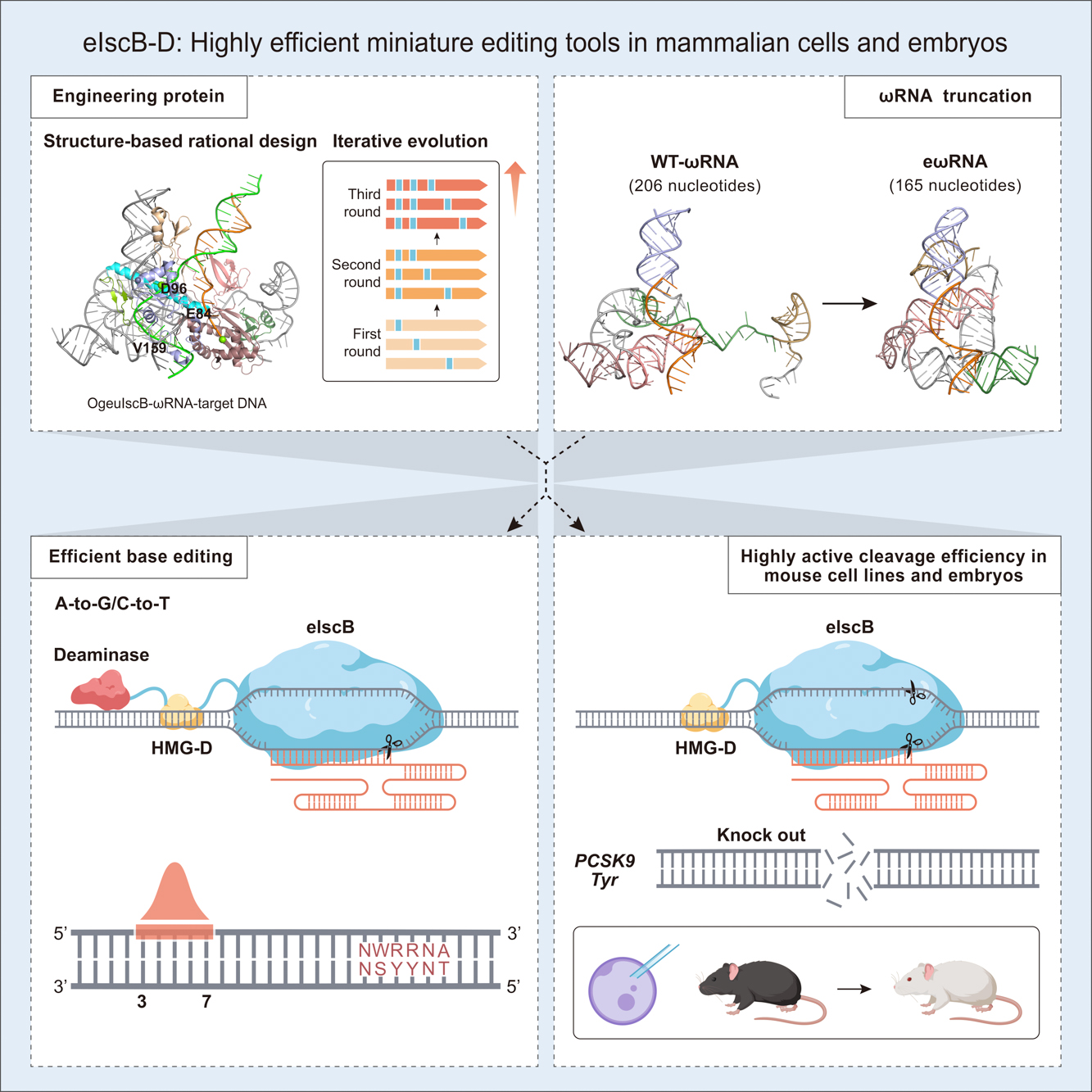
为了全面提升 IscB 的编辑效率,研究人员通过蛋白质工程化改造、RNA 结构优化、胚胎注射等技术获得在哺乳动物细胞及鼠源细胞系中具有超高活性的IscB变体(命名为eIscB-D)。一方面基于结构理性设计在 IscB 蛋白关键位置引物氨基酸突变,经过三轮迭代筛选,获得了增强型 IscB(命名为eIscB)。eIscB 平均编辑效率相较于野生型 IscB 平均可提高7.5倍。此外,研究人员通过融合一个非序列特异性双链 DNA 结合蛋白(HMG-D)提高IscB与目标 DNA 的亲和力,高活性 IscB(命名为eIscB-D)的最高编辑效率可达91.3%。另一方面,为了解决野生型 ωRNA 太长而难以进行工业合成的问题,研究人员通过晶体结构分析,对 ωRNA 的不同茎环结构进行改造,最终获得高活性的 ωRNA(命名为eωRNA)且长度相较于野生型 ωRNA 缩短了20%,大大降低了工业合成的难度。最后优化获得的 eIscB-D/eωRNA 编辑效率相较于原始 IscB/ωRNA 平均可提升20.2倍。
图文摘要
此外,先前并没有研究证明 IscB 在小鼠体内可以产生高效编辑。研究人员首先在小鼠 N2a 细胞系中针对 PCSK9以及 Tyr 基因进行靶点筛选,测序结果表明 eIscB-D 在 PCSK9-sg29 这一靶点可实现58%的编辑效率,在 Tyr-sg21 靶点的编辑效率为47.1%。研究人员随后通过胚胎注射 eIscB-D/eωRNA 系统靶向 Tyr 基因的1号外显子,破坏白化基因的表达,成功制备小鼠白化疾病模型。在 F0 代,75%(9/12只)突变小鼠实现高效编辑(平均编辑效率为58.8%),其中有5只产生白化表型,编辑效率接近100%。该研究首次证明了 eIscB-D 不仅可以在鼠源细胞系中产生高效编辑,并且可以通过胚胎注射高效制备疾病动物模型。
|一款迷你单碱基编辑工具:更高效率、更精准
近年来,陆续报道了一系列小型 Cas 蛋白,包括小型 Cas12f 蛋白、其进化上的祖先 TnpB 以及真核同源物 Fanzor。然而,由于 Cas12f 家族只有一个 RuvC 结构域,难以用于碱基编辑、先导编辑等依赖于缺口酶的衍生技术。
由于 IscB 普遍长度在400-500个氨基酸,与胞嘧啶脱氨酶(APOBEC)、腺苷脱氨酶(TadA)或逆转录酶(RT)融合,构建可由单个 AAV 完整包装的迷你碱基编辑器(BE)或先导编辑器(PE),从而实现安全高效的体内递送。
研究人员通过在 RuvC 结构域关键催化位点引入丙氨酸突变,通过筛选,开发了 IscB 切口酶(eIscBH339A),并与腺苷脱氨酶(TadA-8e)和胞嘧啶脱氨酶(hA3A*)分别融合开发出超高活性的微型单碱基编辑器 eiABE 和 eiCBE,最高位编辑效率分别可达到73.6%和79.2%。
总的来说,该团队开发了高活性的 eIscB-D/ eωRNA 系统,并基于此获得了高效的迷你单碱基编辑工具(eiABE和eiCBE)。最后,通过胚胎显微注射技术高效地构建了白化小鼠疾病模型。这个结果极大地增加了单个 AAV 载体安全高效递送迷你基因编辑工具的可能性,丰富了基因编辑工具的应用场景,为将来用于体内基因治疗提供了高效的候选技术。

IscB小组合影
bat365博士研究生薛念念,硕士研究生洪迪珊,博士后张丹以及硕士研究生王茜为本文的共同第一作者,bat365为第一单位,bat365李大力研究员,朱一凡、王立人副研究员为本文的共同通讯作者。bat365在线登录入口刘明耀教授、宋高洁研究员、关玉婷研究员,以及新加坡国立大学胡纯一教授等对本项研究提供了重要支持。该研究受到了上海市教委前沿科学基地、科技部重点研发计划、国家自然科学基金以及上海市教委科技创新计划和浦江人才计划等支持。
新闻来源:
《分子细胞》封面报道:华东师大团队开发高活性迷你基因编辑工具
附:
论文链接:https://www.sciencedirect.com/science/article/pii/S1097276524005835?via%3Dihub