



钙离子(Ca2+)信号对于几乎所有的生命过程都至关重要。Ca2+信号作为神经活动的指标,在神经导向生长、突触可塑性和学习记忆等过程中发挥着必不可少的重要作用。钙调蛋白(Calmodulin, CaM)是一种广泛表达于真核细胞的Ca2+传感器,可以调节300多种靶蛋白的功能和活性,在Ca2+信号转导过程中处于枢纽地位。在中枢神经系统,突触后膜上的NMDA受体被激活后,引起突触后致密部的局部Ca2+浓度升高,Ca2+ 和CaM结合并使之活化,CaM结合并激活Ca2+/CaM依赖的蛋白激酶IIa(CaMKIIa)。NMDA受体激活的Ca2+-CaM-CaMKIIa 信号通路在突触可塑性(如海马脑区的长时程增强)和学习记忆中起重要作用。

既然CaM的乙酰化在突触可塑性和学习记忆中扮演着重要角色,那么CaM的乙酰化是如何被神经活动调控的呢?为了回答这一问题,首先要找到负责CaM乙酰化的赖氨酸乙酰转移酶(lysine acetyltransferase, KAT)。研究者通过在HEK293细胞内过表达各种KAT, 发现类固醇受体共激活子3(Steroid Receptor Coactivator 3, SRC3)具有最强的乙酰化CaM的能力。研究者接着通过体外乙酰化实验证明了SRC3可以直接乙酰化CaM蛋白,并发现这一过程是Ca2+浓度依赖的。在体实验表明,急性抑制或成年期敲除海马脑区的SRC3,可以削弱神经活动引起的Ca2+-CaM-CaMKIIa 信号通路的激活,并导致海马长时程增强和场景恐惧记忆的损伤。进一步实验表明,急性抑制SRC3对长时程增强和恐惧记忆的损伤可以被模拟乙酰化的CaM蛋白所挽救。上述结果揭示了神经活动通过NMDA受体和Ca2+, 引起SRC3对CaM乙酰化,在突触可塑性和学习记忆中发挥重要作用(图1)。
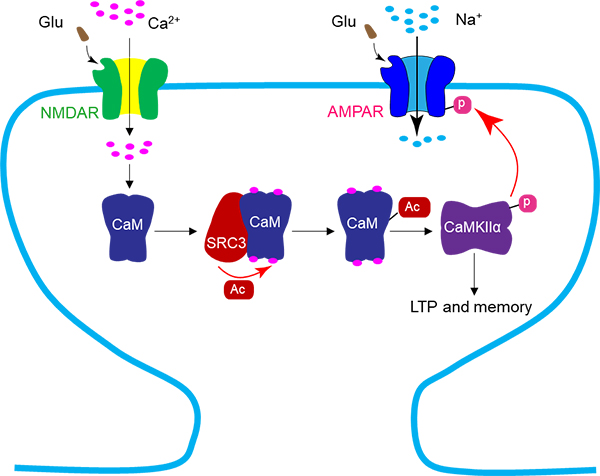
图1 SRC3乙酰化钙调蛋白CaM调节突触可塑性和学习记忆。神经活动激活NMDA受体,Ca2+内流引起SRC3乙酰化CaM,Ac-CaM更强地激活CaMKIIα,从而调控海马长时程增强和场景恐惧记忆。
第二部分研究成果以“SRC3 Acetylates Calmodulin in the Mouse Brain to Regulate Synaptic Plasticity and Fear Learning”为标题,在线发表于美国生物化学与分子生物学会刊,自然指数收录期刊《Journal of Biological Chemistry》。bat365在线登录入口博士生张海龙(现为苏州大学师资博士后)、韩威、硕士生杜银权为论文的共同第一作者,殷东敏研究员为论文的通讯作者(图2)。这两篇论文首次揭示了钙调蛋白(CaM)乙酰化的功能及调控机制,可能对钙离子(Ca2+)信号转导的研究带来新的视角。鉴于以上工作的重要性,这两篇论文被JBC的主编选为“重点推荐”论文(Editors’ Picks),JBC杂志将在线配发专门的评论文章,上述研究成果也将在美国生物化学和分子生物学会的官方网站以新闻形式发布(Press Release)。


图2 殷东敏研究员(中)及主要作者张海龙博士(现在苏州大学工作)、博士生韩威(右)、硕士生杜银权(左)。
殷东敏课题组长期从事突触可塑性和精神分裂症的机制研究。该工作得到了国家自然科学基金委、上海市东方学者和科技启明星计划、中科院神经科学国家重点实验室及上海市重性精神病重点实验室开放课题的资助。
全文链接:https://www.jbc.org/article/S0021-9258(21)00836-X/fulltext(第一篇),
https://www.jbc.org/article/S0021-9258(21)00846-2/fulltext(第二篇)。